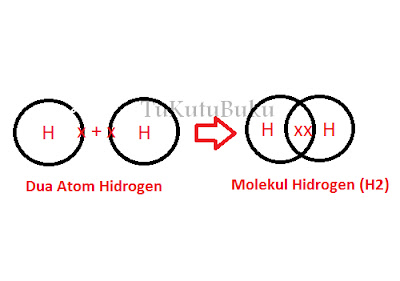
Ikatan Kovalen Tunggal Dan Rangkap - ikatan kovalen adalah ikatan kimia yang melibatkan penggunaan bersama. Sepasang elektron biasanya terjadi pada unsur bukan logam. Bagaimana ikatan kovalen terbentuk ?? Untuk memahami pembentukan ikatan kovalen. Perhatikan dan pembentukan ikatan kovalen pada molekul H2 yang membentuk dari 2 buah atom H. Setiap atom memiliki 1 elektron.
Untuk mencapai konfigurasi seperti gas mulia, atom H memerlukan 1 elektron. Karena mempunyai daya tarik elektron yang sama, antara kedua atom tidak mungkin terjadi serah terima elektron. tidak oleh karena itu memasang elektronnya.
Untuk mencapai konfigurasi seperti gas mulia, atom H memerlukan 1 elektron. Karena mempunyai daya tarik elektron yang sama, antara kedua atom tidak mungkin terjadi serah terima elektron. tidak oleh karena itu memasang elektronnya.
Baca Juga Pengertian Isotop Isobar dan Isoton
Masing-masing atom H menyumbang 1 elektron untuk dijadikan milik bersama. Sepasang elektron itu ditarik oleh kedua inti atom hidrogen bila kedua atau berikatan. Pasangan yang dibentuk dengan menggunakan elektron bersama disebut dengan ikatan kovalen. secara sederhana pembentukan ikatan pada molekul H2 dapat digambarkan seperti berikut:
Masing-masing atom H menyumbang 1 elektron untuk dijadikan milik bersama. Sepasang elektron itu ditarik oleh kedua inti atom hidrogen bila kedua atau berikatan. Pasangan yang dibentuk dengan menggunakan elektron bersama disebut dengan ikatan kovalen. secara sederhana pembentukan ikatan pada molekul H2 dapat digambarkan seperti berikut:
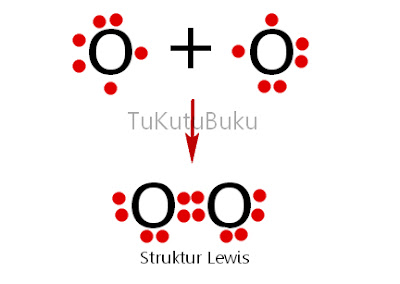
Penggambaran pembentukan ikatan Seperti di atas tersebut disebut struktur Lewis. Penulisan itu dapat dipersingkat dengan mengganti sepasang elektron yang digunakan untuk berikatan dengan mengganti sepasang elektron yang digunakan untuk peningkatan dengan sepotong garis dan menghilangkan semua elektron yang tidak digunakan untuk berikatan. Rumus lewis yang sudah disederhanakan itu disebut dengan rumus bangun atau rumus struktur. Dengan demikian, rumus bangun dari molekul H2 ditulis dengan h-h.
Pembentukan Ikatan Kovalen
Pembentukan ikatan kovalen terbentuk karena adanya pemakaian bersama sepasang elektron namun jika yang digunakan untuk berikatan lebih dari 1 pasangan elektron, ikatan yang terbentuk adalah ikatan kovalen rangkap. Oleh karena itu ada ikatan kovalen rangkap 2 dan ikatan kovalen rangkap 3.
Pembentukan ikatan kovalen dapat dijelaskan dengan berpatokan pada lambang Lewis dan aturan oktet. Pada lambang Lewis semua elektron valensi ditulis. Sedangkan pada aturan oktet dijelaskan bahwa atom akan stabil jika memiliki 8 elektron dan kulit terluarnya kecuali hal yang hanya memerlukan 2 elektron.
Dengan demikian jumlah pasangan elektron yang digunakan untuk berikatan dapat diperkirakan. Jadi antara atau golongan VIIA berikatan dengan kovalen tunggal antaratom golongan VIA ikatan kovalen rangkap 2 dan antar golongan VA berikatan kovalen rangkap 3.
Pembentukan ikatan kovalen dapat dijelaskan dengan berpatokan pada lambang Lewis dan aturan oktet. Pada lambang Lewis semua elektron valensi ditulis. Sedangkan pada aturan oktet dijelaskan bahwa atom akan stabil jika memiliki 8 elektron dan kulit terluarnya kecuali hal yang hanya memerlukan 2 elektron.
Dengan demikian jumlah pasangan elektron yang digunakan untuk berikatan dapat diperkirakan. Jadi antara atau golongan VIIA berikatan dengan kovalen tunggal antaratom golongan VIA ikatan kovalen rangkap 2 dan antar golongan VA berikatan kovalen rangkap 3.
Walaupun demikian, bentuk senyawa harus dapat dibuktikan secara eksperimen. Selain terbentuk dari atom yang senyawa atau segolongan, ikatan kovalen dapat terbentuk dari atom yang berbeda. Contoh molekul yang terbentuk dari atom senama segolongan dan berbeda adalah Cl2, FCl, dan HCl.
Ikatan Kovalen Rangkap
Ikatan Kovalen Rangkap
Pada senyawa HCl, terjadi ikatan kovalen dengan sepasang elektron yang digunakan bersama. Bagaimanakah Ikatan yang terjadi pada molekul O2 dan N2 ikatan kovalen rangkap 2 ???
Ikatan Kovalen Rangkap Dua
Perhatikan terjadinya molekul O2 berikut!
Atom mempunyai 6 elektron di kulit paling luar, untuk dapat mempunyai Susunan oktet, atom itu harus menerima 2 elektron dari atom lain. masing-masing atom O mempunyai susunan oktet apabila terjadi ikatan rangkap pada molekul O2. Hal ini disebabkan adanya dua pasangan elektron yang digunakan bersama.
Ikatan Kovalen Rangkap 3
Perhatikan terjadinya molekul N2 berikut!
Suatu atom mempunyai 5 elektron pada kulit paling luar, untuk mempunyai susunan oktet atau harus menerima 3 elektron dari 1 atom apabila terjadi ikatan kovalen rangkap 3 pada molekul N2. itu disebabkan adanya tiga pasang elektron yang digunakan bersama . contohnya adalah gas karbit.